NCERT Solutions for Acid Bases and Salts Class 10 Notes in Hindi with notes and question Answer with best solution
NCERT Solution for class 10 science Chapter 2 acid bases and salts notes in hindi
Chapter 2 acid bases and salts notes in hindi










लवण (Salts):
लवण : लवण अम्ल एवं क्षारक के उदासीनीकरण अभिक्रिया का आयनिक उत्पाद है |
(i) अम्लीय लवण : अम्लीय लवण प्रबल अम्ल एवं दुर्बल क्षारक के आपसी अभिक्रिया के फलस्वरूप प्राप्त होता है |
अम्लीय लवण (Acidic Salt): NH4Cl
HCl + NH4OH → NH4Cl + H2O
प्रबल अम्ल दुर्बल क्षारक अम्लीय लवण
(ii) उदासीन लवण : उदासीन लवण प्रबल अम्ल एवं दुर्बल क्षारक के आपसी अभिक्रिया से प्राप्त होता है |
उदासीन लवण (Neutral Salt): NaCl
HCl + NaOH → NaCl + H2O
प्रबल अम्ल प्रबल क्षारक उदासीन लवण
(iii) क्षारकीय लवण : क्षारकीय लवण प्रबल क्षारक एवं दुर्बल अम्ल की आपसी अभिक्रिया से प्राप्त होता है |
क्षारकीय लवण (Basic Salt): NaC2H3O2
HC2H3O2 + NaOH → NaC2H3O2 + H2O
दुर्बल अम्ल प्रबल क्षारक क्षारकीय लवण
तनुकरण (dilution) : जल में अम्ल या क्षारक मिलाने पर आयन की सांद्रता (H3O+/OH–) में प्रति इकाई आयतन में कमी हो जाती है | इस प्रक्रिया तो तनुकरण कहते हैं | अम्ल और क्षारक को तनुकृत किया जाता है |
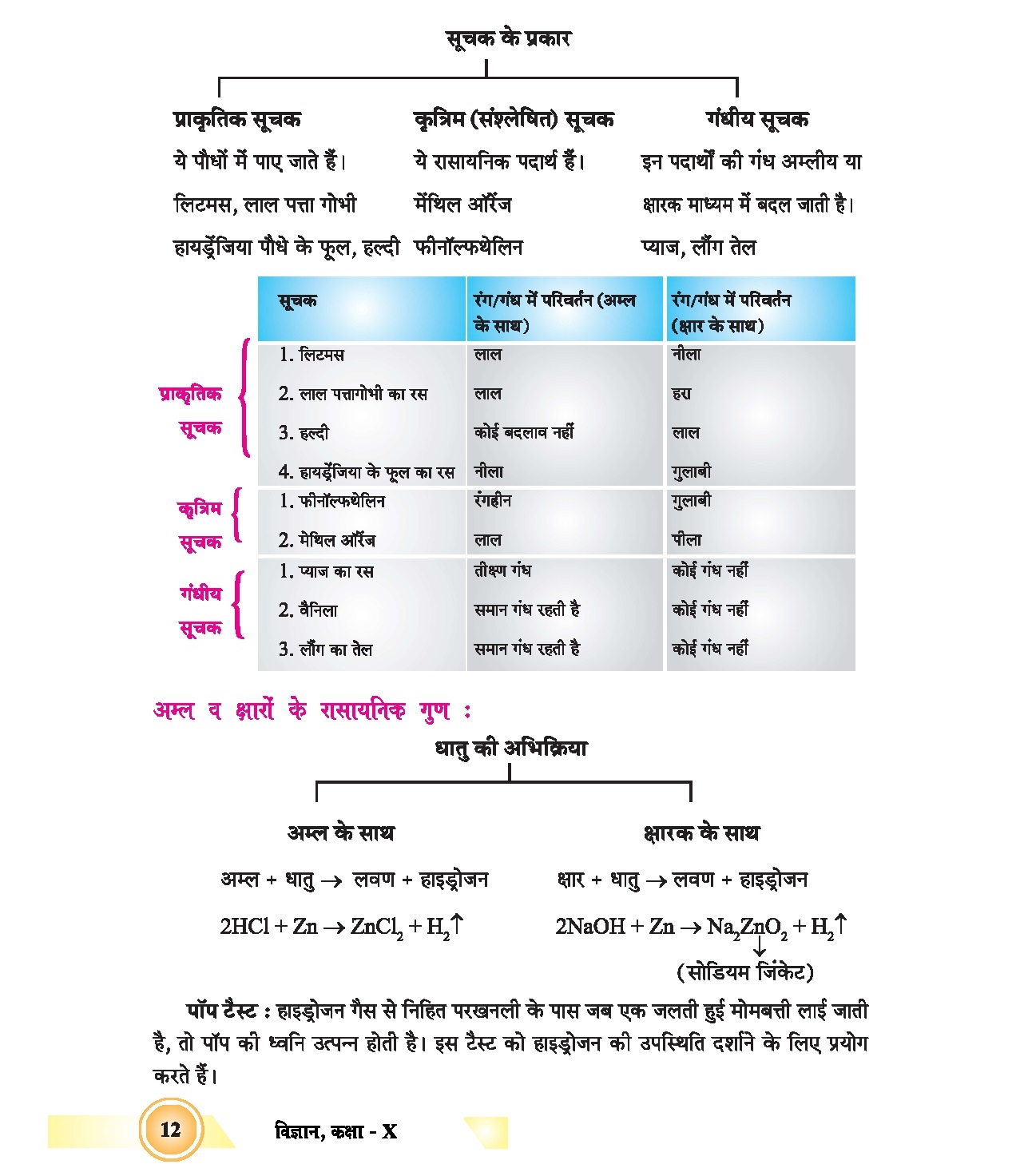
pH स्केल :
किसी विलयन में उपस्थित हाइड्रोजन आयन की सांद्रता ज्ञात करने के लिए एक स्केल विकसित किया गया है जिसे pH स्केल कहते हैं | इस स्केल में 1 से 14 तक अंक अंकित रहते है जो किसी अम्ल या क्षारक की प्रबलता और दुर्बलता के साथ-साथ उनके मान की बताता है |
यह एक प्रकार का सार्वत्रिक सूचक होता है |
- हाइड्रोनियम आयन की सांद्रता जीतनी अधिक होगी उसका pH उतना ही कम होगा |
- किसी भी उदासीन विलयन के pH का मान 7 होगा |
- यदि pH स्केल में किसी विलयन का मान 7 से कम है तो यह अम्लीय होगा | 7 से कम होने पर H+ आयन की सांद्रता बढती है | अर्थात अम्ल की शक्ति बढ़ रही है |
- यदि pH का मान 7 से अधिक है वह क्षार होगा | 7 से अधिक होने पर OH– की सांद्रता बढती है अर्थात क्षारक की शक्ति बढ़ रही है |
प्रबल अम्ल : जिस विलयन में अधिक संख्या में H+ आयन उत्पन्न करने वाले अम्ल प्रबल अम्ल कहलाते हैं |
दुर्बल अम्ल: जबकि कम H+ आयन उत्पन्न करने वाले अम्ल दुर्बल अम्ल कहलायेंगे |
प्रबल क्षारक : जिस विलयन में OH- आयन अधिक संख्या में होते हैं उसे प्रबल क्षारक कहते हैं |
दुर्बल क्षारक : जिस विलयन में OH– संख्या में होते हैंउन्हें दुर्बल क्षारक कहते हैं |
- हमारा रक्त 7.35 – 7.45 pH परास के बीच कार्य करता है जो औसतन pH मान 7.4 होता है |
- यदि रक्त का pH मान 7.45 से अधिक हो जाता है ऐसी अवस्था का एल्केलोसिस (alkalosis) कहते है और यदि रक्त का pH का मान 7.35 से कम हो जाता है, ऐसी अवस्था को एसिडोसिस (acidosis) कहते हैं |
दैनिक जीवन में pH का महत्व :
(i) रक्त और हमारा शरीर : हमारा शरीर 7.0 से 7.8 pH परास के बीच कार्य करता है। जीवित प्राणी केवल संकीर्ण pH परास (परिसर) range में ही जीवित रह सकते हैं। वर्षा के जल की pH मान जब 5.6 से कम हो जाती है तो वह अम्लीय वर्षा कहलाती है।
अम्लीय वर्षा के हानियाँ : अम्लीय वर्षा का जल जब नदी में प्रवाहित होता है तो नदी के जल के pH का मान कम हो जाता है। ऐसी नदी में जलीय जीवधारियों की उत्तरजीविता कठिन हो जाती है।
(ii) मिटटी की अम्लीयता : कई बार किन्ही कारणों से अथवा अम्लीय वर्षा के कारण मिटटी का pH मान कम हो जाने से इस भूमि से अच्छी उपज नहीं मिलती है, चूँकि अच्छी उपज के लिए पौधों को एक विशिष्ट pH परास की आवश्यकता होती है | मिटटी में अम्लीय गुण बढ़ जाने से पौधों को नुकसान पहुँचता है, जिससे फसल अच्छी नहीं होती है |
मिटटी के pH परास को ठीक करने से उपाय : मिटटी के अम्लीयता ख़त्म करने के लिए मिटटी में चाकपाउडर या चूना मिलाया जाता है ताकि इसकी अम्लीयता ख़त्म करके मिटटी की प्रकृति क्षारीय बन जाय |
(iii) अम्लीय माध्यम में भोजन का पचना : pH का महत्व हमारे आमाशय से उत्पन्न हाइड्रोक्लोरिक अम्ल (HCl) से भी है | यह भी एक विशिष्ट pH पर उदर (पेट) को बिना हानि पहुँचाये भोजन के पाचन में सहायता करता है | समान्यत: हमारा उदर का pH परास लगभग 1.5 – 3.5 के बीच कार्य करता है | इनमें भी ये निम्न दो स्थितियाँ होती हैं |
(a) अल्प अम्लता (Hypoacidity) : कुछ व्यक्तियों में HCl का स्राव बहुत कम होता है जिससे उनके भोजन नहीं पचता अथवा कम पचता है | ऐसी अवस्था को अल्प-अम्लता (अपच) कहते है | ऐसे व्यक्ति को अपने भोजन के साथ अम्लीय पदार्थ जैसे निम्बू या सिरका लेना पड़ता है, अथवा पाचक-रस उत्पन्न करने वाली औषधीयाँ लेना पड़ता है |
(b) अति-अम्लता (Hyperacidity) : उदर में अत्यधिक अम्ल उत्पन्न होने की स्थिति में व्यक्ति उदर में दर्द एवं जलन का अनुभव करता है | इस दर्द या जलन से मुक्त होने के लिए ऐन्टासिड (antacid) लेना पड़ता है |
Antacid (प्रति-अम्ल औषधि) : ऐन्टासिड अम्ल के प्रभाव को कम करने वाले दुर्बल क्षारक होते है | जैसे – मिल्क ऑफ़ मैग्नेशिया (मैग्नेशियम हाइड्रोऑक्साइड), एल्युमीनियम हाइड्रोऑक्साइड तथा सोडियम हाइड्रोऑक्साइड जैसे दुर्बल क्षारक ऐन्टासिड के संघटक में शामिल होते है | ये अम्लीय प्रभाव को उदासीन कर देते हैं |
(iv) दन्त-क्षय (tooth-caries/tooth-decay) : समान्यत: मुँह का pH 5.5 रहता है | यदि इसका मान 5.5 से कम हो जाए तो दन्त-क्षय प्रारंभ हो जाता है | दाँतों का इनैमल (दत्तवल्क) कैल्शियम फोस्फेट का बना होताहै जो शरीर का सबसे कठोर पदार्थ है | यह दाँतों की बाहर से बचाव करता है | जब मुँह का pH 5.5 से कम हो जाता है तो यह धीरे-धीरे संक्षारित होने लगता है |
मुँह का pH कम होने का कारण : जब हम भोजन या कोई मीठी चीज खाते हैं तो भोजन के पश्चात् मुँह में अवशिष्ट शर्करा एवं खाद्य पदार्थ रह जाते है जिस पर मुँह में उपस्थित बैक्टीरिया उसका निम्नीकरण करते है और उससे अम्ल उत्पन्न करते है | यह अम्ल इनेमल को नष्ट कर देता है जो दंत-क्षय का प्रमुख कारण बनता है |
दन्त-क्षय से बचाव (Protection from Tooth-Decay) : भोजन के बाद मुँह साफ करने से इससे बचाव किया जा सकता है। मुँह की सफाई के लिए क्षारकीय
दंत-मंजन का उपयोग करने से अम्ल की आधिक्य मात्रा को उदासीन किया जा सकता
है जिसके परिणामस्वरूप दंत क्षय को रोका जा सकता है।
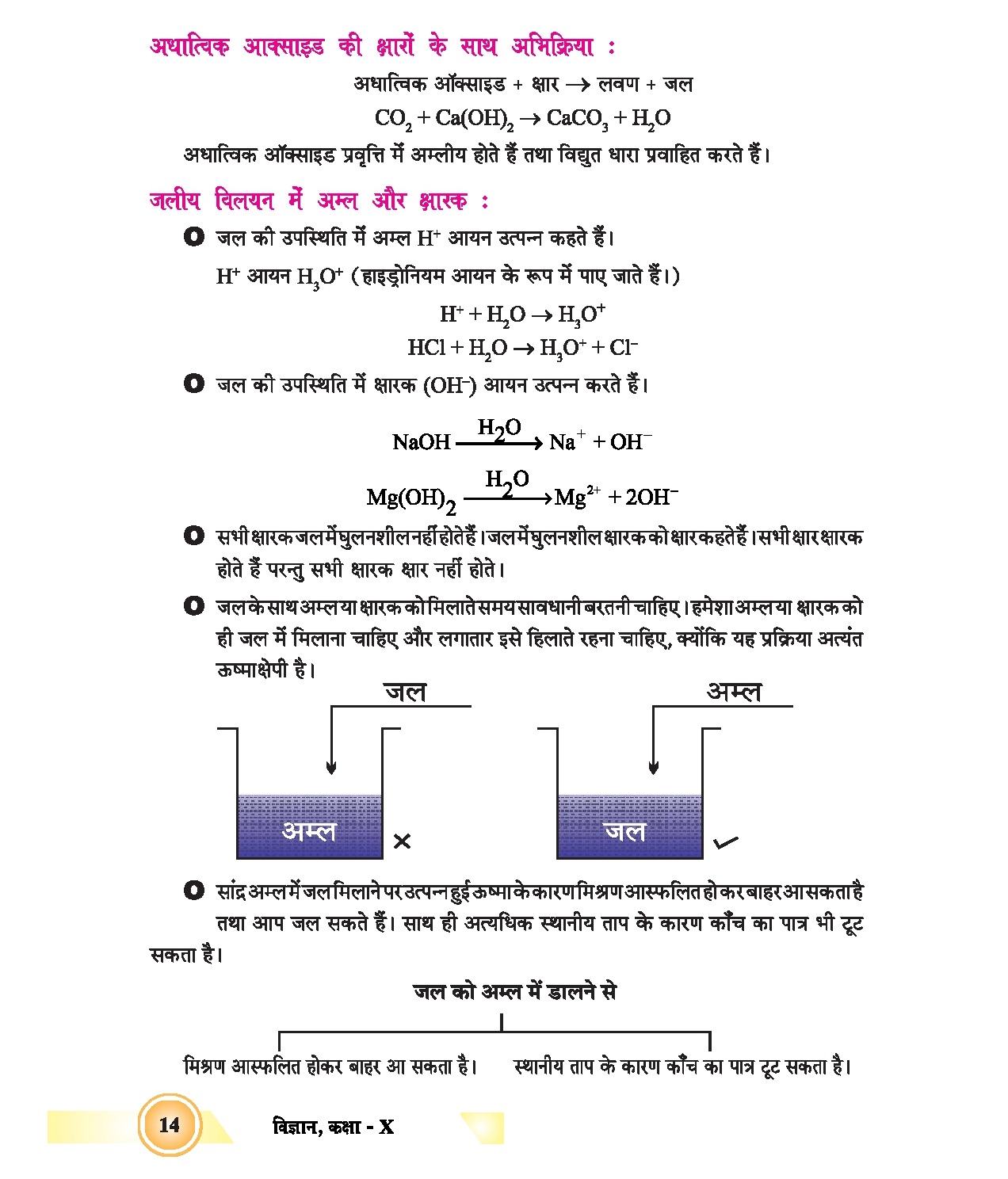
क्लोर-क्षार प्रक्रिया (Chlor-Alkali Process) :
जब सोडियम क्लोराइड (साधारण नमक) के जलीय विलयन से विद्युत धारा प्रवाहित की जाती है तो यह वियोजित होकर सोडियम हाइड्रोऑक्साइड, क्लोरीन गैस और हाइड्रोजन गैस प्रदान करता है | इस प्रक्रिया को क्लोर-क्षार प्रकिया कहते हैं
इस प्रक्रिया का रासायनिक समीकरण निम्न है :
2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + Cl2 (g) + H2(g)

सोडियम क्लोराइड का विद्युत अपघटन
जब सोडियम क्लोराइड के जलीय विलयन से विद्युत प्रवाहित की जाती है तो इसके एनोड से क्लोरीन गैस और कैथोड से हाइड्रोजन गैस उत्पन्न करता है | सोडियम हाइड्रोऑक्साइड विलयन इसके कैथोड के पास बनता है |
क्लोर-क्षार प्रक्रिया के उत्पाद (Products of chlor-alkali Process):
- सोडियम हाइड्रोऑक्साइड (Sodium Hydroxide)
- क्लोरीन गैस (Chlorine Gas)
- हाइड्रोजन गैस (Hydrogen Gas)
सोडियम हाइड्रोऑक्साइड का उपयोग (Uses of Sodium Hydroxide):
- इसका उपयोग धातुओं से ग्रीज हटाने के लिए किया जाता है |
- साबुन और अपमार्जक बनाने में किया जाता है |
- इसका उपयोग कागज बनाने में भी किया जाता है |
- और इसका उपयोग कृत्रिम फाइबर बनाने में किया जाता है |
क्लोरीन गैस का उपयोग (Uses of Chlorine gas):
- क्लोरीन गैस का उपयोग जल की स्वच्छता के लिए किया जाता है |
- स्विमिंग पूल में
- PVC, CFCs और कीटाणुनाशक बनाने ने किया जाता है |
- और इसका उपयोग रोगाणुनाशक बनाने में भी किया जाता है |
हाइड्रोजन गैस का उपयोग (Uses of hydrogen):
- इसका उपयोग ईंधन के लिए किया जाता है |
- इसका उपयोग मार्गरीन बनाने के लिए किया जाता है |
- और इसका उपयोग खाद के लिए अमोनिया बनाने के लिए किया जाता है |

हाइड्रोक्लोरिक अम्ल का उत्पादन (Production of Hydrochloric acid): क्लोरीन और हाइड्रोजन क्लोर-क्षार प्रक्रिया के महत्वपूर्ण उत्पादन है, जिनका उपयोग हाइड्रोक्लोरिक अम्ल के उत्पादन में किया जाता है | हाइड्रोक्लोरिक अम्ल एक महत्वपूर्ण रसायन है जिसका उपयोग निम्न पदार्थों के उत्पादन में किया जाता है |
- दवाइयों के निर्माण में,
- सौन्दर्य प्रसाधन के निर्माण में,
- अमोनियम क्लोराइड के निर्माण में और
- इस्पात के सफाई के लिए प्रयोग होता है |
विरंजक चूर्ण का उत्पादन (Production of Bleaching powder): क्लोर-क्षार प्रक्रिया से प्राप्त क्लोरीन और सुखे बुझे हुए चूने की क्रिया से विरंजक चूर्ण का निर्माण होता है |
इस प्रक्रिया का रासायनिक समीकरण निम्नलिखित है :
Ca(OH)2 + Cl2 → CaOCl2 + H2O
विरंजक चूर्ण का उपयोग (Used of Bleaching powder) :
- वस्त्र उद्योग में सूती एवं लिनेन के विरंजन के कागज़ की पैफक्ट्री में लकड़ी के मज्जा एवं लाउंड्री में साफ कपड़ों के विरंजन के लिए
- कई रासायनिक उद्योगों में एक उपचायक के रूप में, एवं
- पीने वाले जल को जीवाणुओं से मुक्त करने के लिए रोगाणुनाशक के रूप में
बेकिंग सोडा का उत्पादन (Production of Baking soda):
इस यौगिक का रासायनिक नाम सोडियम हाइड्रोजनकार्बोनेट (NaHCO3) है। कच्चे
पदार्थों में सोडियम क्लोराइड का उपयोग कर इसका निर्माण किया जाता है।.
इसका रासायनिक समीकरण निम्न है :
NaCl + H2O + CO2 + NH3 → NH4Cl + NaHCO3
(अमोनियम क्लोराइड) (सोडियम हाइड्रोजन कार्बोनेट)
इस प्रकिया के दो महत्वपूर्ण उत्पाद है (i) अमोनियम क्लोराइड और (ii) बेकिंग सोडा
बेकिंग सोडा का उपयोग :
- सोडा का उपयोग आमतौर पर रसोईघर में स्वादिष्ट खस्ता पकौड़े बनाने के लिए किया जाता है।
- कभी-कभी इसका उपयोग खाने को शीघ्रता से पकाने के लिए भी किया जाता है।
- यह एक दुर्बल क्षारक भी है जिसका उपयोग कई बार अति-अम्लता की स्थिति में की जाती है | यह ऐन्टैसिड का संघटक भी है |
- इसका उपयोग सोडा-अम्ल अग्निशामक में भी किया जाता है |
- इसका उपयोग बेकिंग पाउडर को बनाने में किया जाता है |
खाना पकाते समय जब इसे गर्म किया जाता है तो निम्न अभिक्रिया होती है :

बेकिंग पाउडर का निर्माण : बेकिंग सोडा एवं टार्टरिक अम्ल जैसा मंद खाध्य अम्ल के मिश्रण से बेकिंग पाउडर का निर्माण होता है |
जब बेकिंग पाउडर को जल में मिलाकर गर्म किया जाता है तो यह कार्बन डाइऑक्साइड जल और अम्ल का सोडियम लवण प्रदान करता है जिसकी निम्न अभिक्रिया होती है :
NaHCO3 + H+ → CO2 + H2O + अम्ल का सोडियम लवण
इस अभिक्रिया से कार्बन डाइऑक्साइड उत्पन्न होता है जो ब्रेड या केक को फुलाने, स्पोंजी बनाने या मुलायम बनाता है |
Class 10th Science Other Chapter Solution
- Chapter 1: Chemical Reactions and Equations
- Chapter 1: रासायनिक अभिक्रिया एवं समीकरण
- Chapter 2: Acids, Bases, and Salts
- Chapter 2: अम्ल, क्षार एवं लवण : लवण
- Chapter 3: Metals and Non-Metals
- Chapter 4: Carbon and its Compounds
- Chapter 5: Periodic Classification of Elements
- Chapter 6: Life Processes
- Chapter 7: Control and Coordination
- Chapter 8: How do Organisms Reproduce?
- Chapter 9: Heredity and Evolution
- Chapter 10: Light – Reflection and Refraction
- Chapter 11: Human Eye and Colourful World
- Chapter 12: Electricity
- Chapter 13: Magnetic Effects of Electric Current
- Chapter 14: Sources f Energy
- Chapter 15: Our Environment
- Chapter 16: Management of Natural Resources
